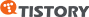피부는 표면에서 가까운 순서로 표피, 진피, 및 피하 조직의 세 부분으로 크게 나눌 수 있습니다. 또 표피는 몇 개의 층으로 나뉘는데, 이 층들은 표면에서 가까운 것부터 각질층, 과립층, 유극층, 기저층이라고 불립니다. 표피 최하층인 기저층은 진피와 접하고 있습니다. 진피에는 혈관, 신경, 모낭, 피지샘, 한선(땀샘), 털세움근(털을 꼿꼿이 바로 서게 하는 근육) 등의 조직이 있습니다.
표피층은 각질형성세포(keratinocyte), 멜라닌세포(melanocyte), 랑게르한스(Langerhans)세포, 메르켈촉각세포(Merkel)로 구성되어 있으며, 진피층은 섬유아세포(fibroblast), 비만세포(mast cell), 조직구(histiocyte), 림프구(lymphocyte) 등의 세포와 교원 섬유 및 탄력 섬유의 결체 조직, 그리고 특별한 형체가 없는 기질로 구성되어 있습니다.
피부암은 피부를 구성하고 있는 모든 조직과 세포에서 발생할 수 있습니다.
이런 기능을 담당하고 있는 피부는 나이가 들면 변화가 나타나며, 특히 햇빛에 만성적으로 노출되면 노화가 가속화됩니다. 노화가 진행되면 피부는 건조해지고 탄력성이 소실되면서 얇아지고 주름이 지며 피하지방층이 감소됩니다. 노화에 의한 피부 변화는 피부의 상해나 피부 질환에 대한 위험성을 증가시킵니다.
암의 사전적 의미는 ‘끝없이 분열을 하여 혈액이나 림프관을 통하여 다른 장기에까지 전파될 수 있는 세포의 덩어리’, 즉 ‘악성 신생물’입니다. 피부암이란 인체의 가장 바깥층인 피부에서 발생한 암으로, 처음부터 피부에서 발생한 경우 이를 원발성 피부암이라 하고, 다른 장기에서 발생하여 피부로 전이된 피부암의 경우에는 전이성 피부암이라고 합니다.
내부 장기암(이하 전이암)의 피부 전이는 다른 장기로의 전이에 비해 비교적 드물며 대부분이 암의 말기에 나타나지만, 간혹 원발암보다 먼저 발견되는 경우도 있습니다. 이렇게 원발암보다 먼저 발견된 전이성 피부암은 원발암을 진단하는데 도움이 될 수 있으며, 원발암 진단 후 발견된 전이성 피부암은 치료의 방침을 결정하거나 예후를 예견하는데 있어 중요한 임상적 의의를 갖습니다.
일반적으로 피부암은 처음부터 피부에서 발생한 원발성 피부암만을 의미하며, 좁은 의미로는 가장 흔하게 발생하는 편평세포암, 기저세포암, 악성흑색종의 세 가지 암을 의미합니다. 또한 피부암은 크게 악성흑색종과 비흑색종성피부암(편평세포암, 기저세포암 등이 속함)으로 나누어 볼 수가 있습니다.
편평상피세포암은 표피의 각질형성세포에서 유래한 악성 종양입니다. 종양의 크기 및 깊이, 원인, 해부학적 위치, 조직학적 특성에 따른 전이 등의 생물학적 양상이 기저세포암보다 복잡한 비흑색종성 피부암으로 우리나라에서 기저세포암과 함께 가장 많은 피부암의 하나입니다.
기저세포암은 표피의 최하층인 기저층이나 모낭 등을 구성하는 세포가 악성화한 종양으로 편평상피세포암과 함께 가장 흔한 비흑색종성피부암이며, 국소적으로 침윤하고 전이가 드문 악성 종양입니다.
악성흑색종은 멜라닌세포의 악성 종양으로 멜라닌세포가 존재하는 곳에는 어느 부위에서나 발생할 수 있으나 피부에 가장 많이 발생합니다. 멜라닌세포는 사람의 피부색을 결정하는 멜라닌 색소를 생성하는 세포이며, 멜라닌은 자외선으로부터 피부를 보호하는 기능을 가지고 있습니다. 악성흑색종은 이 멜라닌세포 또는 모반(점)세포가 악성화한 것으로 악성도가 높습니다.
그 외에도 피부에는 다양한 종류의 암이 발생할 수 있습니다. 피부에 발생할 수 있는 암의 종류의 몇 가지 예로는 혈관육종(angiosarcoma), 융기성 피부섬유육종(dermatofibrosarcoma protuberans, DFSP), 파젯병(Paget's disease), 피지선암(sebaceous carcinoma), 에크린암(eccrine carcinoma), 아포크린선암(apocrine gland carcinoma) 피부림프종(Cutaneous lymphoma) 등을 들 수 있습니다.
2011년에 발표된 중앙암등록본부 자료에 의하면 2009년에 우리나라에서는 연 192,561건의 암이 발생되었는데, 그 중 피부암은 남녀를 합쳐서 연 3,347건으로 전체 암 발생의 1.74%를 차지하였습니다. 남녀의 성비는 0.8:1로 여자에게서 더 많이 발생하였습니다. 발생건수는 남자가 연 1,475건, 여자가 연 1,872건이었습니다. 남녀를 합쳐서 본 연령대별로는 70대가 29.3%로 가장 많고, 60대가 23.2%, 80대 이상이 20.6%의 순입니다.(보건복지부 중앙암등록본부 2011년 12월 29일 발표 자료)
자외선은 각질세포에 있는 암 발생 유전자의 DNA를 변형시킴으로써 암 생성을 유발합니다. 암 억제 유전자의 기능이 마비된 채 더 많은 양의 자외선을 쬐게 되면 표피세포에 광선 각화증이 발생하고, 지속적인 자외선의 노출은 각화증을 편평상피세포암으로 전환시킬 수 있습니다. 조직학적으로 광선 각화증은 비정상적인 표피세포로 구성되어 있습니다.
이 암을 일으키는 요인으로서 가장 먼저 생각해 볼 수 있는 것은 자외선의 영향입니다. 단기간에 대량의 자외선을 쪼이는 것은 물론 어릴 때부터 축적된 자외선의 영향에 의해서도 암이 발생하기 때문에 인구의 고령화에 따라 얼굴이나 목, 손등 등 햇빛에 노출되는 부분에서 생기는 편평상피세포암이 증가하는 추세입니다.
생활습관도 영향을 주는데 등산, 낚시, 골프, 스키 등 스포츠 레저 활동 증가 및 일광욕을 자주 즐기는 등 생활습관의 서구화로 자외선 노출이 늘고 있으며, 최근에는 환경오염으로 인한 오존층 파괴로 지표에 도달하는 자외선 양이 증가되어 피부암이 증가되고 있습니다. 연구에 의하면 대기중의 오존층이 1% 감소함에 따라 편평상피세포암의 발생빈도는 2% 증가한다고 합니다.
편평상피세포암의 발생요인 중 하나로 인유두종바이러스(human papilloma virus, HPV)가 관련이 있을 수 있습니다. 인유두종바이러스는 자궁경부암 등의 발병요인으로서 알려져 있었는데, 피부의 편평상피세포암의 발생과도 관련이 있을 수 있다는 사실이 밝혀지게 되었습니다. 모든 종류의 편평상피세포암의 원인이 되는 것은 아니며 구강, 성기부에 발생한 암이나 손발톱의 편평상피세포암, 신장 이식환자에서 발생한 암에서 일부 연관이 있을 수 있습니다. 그리고 드문 질환인 사마귀표피형성이상(epidermodysplasia verruciformis)에서 인유두종바이러스와 연관되어 편평상피세포암이 발생할 수 있습니다.
그 밖에도 편평상피세포암에는 전부터 알려져 있는 발생요인이 몇 가지 있습니다. 그것은 화상이나 외상의 흉터, 다리 정맥 혈액의 정체에 의해 발생하는 궤양, 골수염에 의한 누공, 완치하기 어려운 만성 농피증이라는 엉덩이 피부의 질환, 장기간에 걸친 욕창, 방사선 치료 후에 생기는 만성 방사선 피부염, 장기간 열에 노출되는 경우 등입니다. 또한 직업적으로 타르 종류 및 광물기름 등과의 장기적인 접촉이 피부암의 발생에 관여하는 경우도 있습니다. 그리고 장기이식, 백혈병 등 만성적으로 면역이 억제된 환자에서 발생률이 증가하며 구강이나 두경부에 생기는 편평상피세포암의 경우 유전적 염색체의 결손도 보고되고 있습니다. 최근에는 신장이식 환자에서 편평상피세포암과 기저세포암의 발생 빈도가 높은 것이 알려지면서 면역 억제도 중요한 발생 요인으로 알려져 있습니다.
국내에서는 재래식 환약을 복용한 사람에게서 환약에 포함된 비소 화합물로 인해 수년이 경과한 후에 전신에 피부암이 발생하는 경우가 종종 있습니다.
피부를 과도하게 일광에 노출시키는 것은 피부암 발생의 주요 원인입니다. 자외선은 암발생 억제유전자인 p53 유전자의 돌연변이를 유발하고 면역 반응을 억제하여, 피부암을 유발하는 것으로 생각됩니다. 피부의 과도한 자외선에의 노출은 기저세포암과 편평상피세포암에서 모두 연관성을 가지고 있는데, 기저세포암의 경우 간헐적으로 짧은 시간 내에 과다 노출되는 것과 연관되어 있고 편평상피세포암의 발생은 자외선의 노출량과 직접적인 상관관계(linear correlation)를 갖습니다.
태양광선은 파장에 따라 자외선, 가시광선, 적외선으로 나눌 수 있습니다. 이 중 자외선이 피부에 광생물학적 반응을 유발하는 중요한 광선입니다. 자외선은 다시 파장에 따라 자외선 A(320-400nm), 자외선 B(280-320nm), 자외선 C(200-280nm)로 나뉩니다. 이 중 자외선 C는 오존층에 의해 제거되어 지표에는 도달하지 않으며, 자외선 A와 자외선 B는 지표면에 도달하여 피부에 많은 영향을 미칩니다.

자외선은 파장이 짧을수록 높은 에너지를 가지며, 파장이 길수록 투과력이 높아지는 특징을 가지고 있습니다. 파장이 상대적으로 짧은 자외선 B는 에너지가 높아 자외선 A의 1/1000의 양으로도 홍반을 일으킬 수 있지만, 투과력은 낮아 유리창에 의해 차단되며 피부에서도 주로 표피에 작용하게 됩니다. 자외선 A의 경우 에너지는 낮지만, 자외선의 90% 이상을 차지하여 자외선 B보다 10배나 많이 존재합니다. 자외선 A는 투과력이 높아 진피까지 침투하고 세포막에 손상을 주어 피부 노화에 중요한 역할을 합니다.

자외선 B는 일광화상과 광발암현상에서 자외선 A보다 1000배 정도 강력한 작용을 하는 것으로 알려져 있으며, 과거에는 이를 막기 위한 자외선 차단제만 개발되었습니다. 그러나 최근에는 자외선 A가 피부 노화에 중요한 역할을 한다는 사실이 알려지게 되어 자외선 A와 B를 모두 차단하는, 즉 광범위한 파장대의 태양광선을 차단할 수 있는 자외선차단제(sun screen)가 개발되어 사용되고 있습니다.
자외선을 쪼였을 때 태닝(tanning)이 잘 되지 않으면서, 일광 화상을 많이 입는 사람에게서 피부암이 발생할 위험이 높습니다. 예를 들면 백인의 경우처럼 피부색이 하얗고, 금발이나 붉은 색의 머릿결을 가지며, 주근깨가 현저하고, 푸른색이나 녹색의 눈을 갖는 사람들에게서 피부암이 발생할 위험이 높습니다.
가족 중에 악성흑색종이 발생했던 경우 악성흑색종이 좀 더 조기에 발생할 수 있으며, 이형성 모반(점)도 다발성으로 발생할 확률이 더 높습니다. 따라서 가족 중에 악성흑색종의 과거력이 있는 사람이 있다면 색소성 병변에 대한 보다 주의 깊은 관찰이 필요합니다. 또한 유전 질환 중에서 피부암의 발생 위험을 높이는 것들이 있는데, 그 예로는 Rombo 증후군, Bazex 증후군, 색소성 건피증, 모반양 기저세포암 증후군 등이 있습니다.
타르(tar)나 비소(arsenic), 방향족의 탄화수소 등의 물질에 반복적으로 노출될 경우 편평상피세포암이 발생할 수 있습니다. 특히 담배나 술은 구강에서 발생하는 편평상피세포암과 큰 연관성이 있습니다.
선천성 모반과 후천성 모반 모두에서 악성흑색종이 발생할 수 있으며, 악성흑색종의 약1/3이 모반과 연관됩니다. 모반의 수가 많을수록 악성흑색종의 발생 위험도 높아지며, 악성흑색종의 가족력이 있는 경우 비전형적 모습을 보이는 모반(이형성 모반) 또한 악성흑색종의 발생 위험을 높입니다. 한 보고에 따르면 이형성 모반이 하나 있는 경우 악성흑색종의 발생 위험이 2배가 되며, 10개 이상 있는 경우 12배까지 위험도가 높아집니다. 그리고 선천성 모반의 크기가 클수록 악성흑색종의 발생 위험이 높아지는데, 선천성 모반의 크기가 체표 면적의 5%를 넘을 때 평생 동안 악성흑색종이 발생할 확률은 6.3% 이상입니다.
이형성 모반은 전형적인 후천성 멜라닌세포성모반(일반적인 점)과는 다른 몇 가지 특징을 가지고 있습니다. 일반적으로 크기가 5mm 이상으로 크고, 두 가지 이상의 색조(갈색, 분홍색, 검정색 등)가 불규칙하게 배열되어 있으며, 그 경계 부위 또한 불규칙하고 불분명합니다. 이형성 모반의 개수가 많을수록 악성흑색종의 위험도가 높아지며, 단 한개만 있어도 발생 위험도가 약 2.3배 증가하게 됩니다. 병변의 개수가 1-2개로 적을 경우에는 완전절제 후 평생 동안 주기적인 검진을 받아야 하며, 병변의 개수가 많을 경우 모든 병변을 제거할 필요는 없지만, 두피나 항문 부위 등 주기적으로 관찰하기 어려운 부위는 제거하는 것이 고려되어야 합니다. 이형성 모반을 진단받았을 때는 최소한 1-2개월에 한 번 정도는 자가검진을 시행하여야 하며, 위험도에 따라 3-12개월마다 피부과 전문의에게 정기검진을 받아야 합니다.
편평상피세포암은 남자에서 2배 정도 더 많이 발생하며, 40세 이후에 발생 위험도가 증가합니다. 기저세포암은 남자에서 조금 더 흔히 발생하며, 고령자에게 주로 발생합니다.
장기 이식, 백혈병, 림프종, 면역억제제의 사용과 같은 만성적인 면역억제로 인해 피부암이 발생할 수 있습니다.
이전에 피부암이 발생했던 경우 다른 피부암의 발생 위험이 높아집니다. 편평상피세포암 진단 후 3-5년 뒤에 비흑색종성피부암(편평상피세포암과 기저세포암)이 발생할 확률은 약 50% 정도이고, 기저세포암 발생 후 악성흑색종이 발생할 확률이 3배 정도 높아진다는 보고도 있습니다. 따라서 이전에 피부암이 발생했던 적이 있다면 3-12개월 간격으로 주기적인 관찰이 필요합니다.
대표적인 전암 병변으로는 광선각화증과 보웬병이 있습니다. 이러한 전암 병변은 치료하지 않을 경우 편평세포암으로 진행될 수 있으며, 비흑색종성피부암(편평상피세포암, 기저세포암)의 강력한 예측인자로서 작용합니다.

장기간의 일광 노출 부위에 주로 발생하며, 쉽게 일광화상을 입고 태닝(tanning)이 잘 안 되며 주근깨가 많이 나는 백인에게서 발생 위험이 높습니다. 일반적으로 일광 노출 부위에 경계가 불분명한 적갈색의 인설성 병변으로 나타나며, 아랫입술에도 흔히 나타나는데 이는 광선구순염(actinic cheilitis)이라 합니다. 만성적인 일광 노출로 인해 발생하기 때문에 피부 주변에서 잡티 등의 얼룩덜룩한 색소성 병변이 발생하며, 모세혈관확장증이나 일광탄력섬유증, 그리고 거칠고 깊은 주름 등 광노화와 관련된 변화가 눈에 두드러지게 나타납니다. 광선각화증이 편평상피세포암으로 이행하는 비율은 보고에 따라 1% 미만에서 20%까지로 아직 정확히 알려져 있지는 않지만, 이는 결국 만성적인 일광에의 손상을 의미하는 것이므로 비흑색종성피부암이 발생할 위험을 가지고 있는 사람들을 알아내는 임상적인 의미가 있습니다.
보통 60세 이상에서 발생하며, 남녀에게서 동등한 비율로 발생합니다. 전신 어디에서나 발생할 수 있는데 노출 부위의 병변은 만성적인 일광 노출이 중요한 요인이며, 그 외 비소나 이온화 방사선에의 노출, 면역억제, 인유두종바이러스(HPV)의 감염 등에 의해 발생하기도 합니다. 병변 부위는 경계가 명확한 홍반성 판으로 불규칙한 경계를 가지고 있으며, 각질이나 가피로 덮여 있습니다. 또한 간혹 과다각화되어 사마귀양 병변을 보이는 경우도 있습니다. 보웬병의 5% 정도가 악성화 되어 편평상피세포암으로 진행하며, 이 중 약 33%에서 전이가 이루어질 수 있습니다. 또한 보웬병이 있는 경우 다른 피부암의 발생률도 높아, 보웬병 환자의 약 30-50%에게서 다른 비흑색종성피부암이 발생한다는 보고가 있습니다.
의학적, 직업적인 방사선 노출, 화상 반흔(흉터), 만성 궤양, 농루 등으로 인한 만성적인 피부 병변, 만성적으로 열에 노출이 됐을 경우(열성홍반 등), 고용량의 PUVA 광화학치료 등이 피부암의 발병률에 영향을 줄 수 있습니다.
피부암을 예방하는데 있어 가장 중요한 것은 일광 노출을 피하는 것과 전암 병변을 조기에 발견하여 치료하는 것입니다.
가장 흔한 3가지 피부암(편평상피세포암, 기저세포암, 악성흑색종)의 발생이 모두 자외선과 연관이 되어 있으므로 평소에 자외선으로부터 피부를 보호하는 것이 무엇보다 중요한 피부암 예방법입니다.
약 80%의 피부암은 태양빛으로부터 피부를 보호함으로써 예방할 수 있습니다. 피부색에 관계없이 누구나 피부암의 위험이 있으므로 모든 사람이 태양광선으로부터 피부를 보호할 필요가 있습니다. 외출하기 전에 태양광선을 차단할 양산이나, 모자, 긴 옷 그리고 자외선차단제, 썬글라스 등을 준비하는 것이 좋습니다. 태양광선이 특히 강한 오전 10시에서 오후 4시 사이에는 가급적 야외 활동을 자제하는 것이 좋습니다.
태양광선은 물, 모래, 콘크리트, 눈(snow) 등에 의해 반사될 수 있으며, 이러한 반사광에 의해 더 많은 자외선에 노출될 수 있으므로 주의해야 합니다. 또한 자외선은 수면 아래까지 미칠 수 있습니다. 구름은 온도를 낮추어 시원하게 해 줄지는 몰라도 피부암을 유발하는 자외선을 막아주지는 못합니다.
피부를 자외선으로부터 가능한 한 많이 보호하려면 자외선차단제 이외에도 옷으로 차단하는 것이 좋은 방법입니다. 소매 있는 옷, 긴 바지 그리고 얼굴, 목, 귀 등을 가릴 수 있는 모자를 쓰는 것이 좋습니다. 일부 의약품은 피부를 태양에 더 민감하게 할 수 있으므로 의사나 약사에게 자신이 먹는 약이나 기타 처방에 대해 상담을 해야 합니다.
아이들은 피부에 각별히 주의할 필요가 있습니다. 아이들은 그늘에서 놀도록 하고, 피부를 보호할 수 있는 옷을 입혀야 하며 자외선차단제를 정기적으로 발라줘야 합니다. 생후 6개월 미만의 아이에게는 자외선차단제를 발라주는 것이 적합하지 않으므로, 유아는 그늘에 두고 천으로 자외선을 가려주는 것이 좋습니다.
자외선 차단제는 태양광선을 반사시키거나 분산시키는 물리적 자외선 차단제와 자외선을 흡수하여 자외선의 양을 줄이는 화학적 자외선 차단제로 나뉩니다. 자외선 차단제를 선택할 때 유의해서 볼 것은 자외선 차단지수(Sun Protection Factor, SPF)와 PA입니다.
SPF는 자외선 차단 제품을 바른 후 최소 홍반량/자외선 차단 제품을 바르지 않은 상태의 최소 홍반량을 나타내며, 주로 자외선 B를 차단하는 능력을 나타냅니다. 즉, SPF가 15라면 자외선 차단제를 바르기 전에는 20분 만에 홍반이 나타난 사람의 경우 20분의 15배인 300분이 지나야 홍반이 나타난다는 의미입니다.
자외선 A를 차단하는 지표는 아직까지 명확하게 정해져 있지는 않습니다. PA는 자외선 A를 얼마만큼 차단해 주는지를 나타내는 지표의 하나로, Protection Grade of UVA의 약자입니다. 자외선 A에 의해 발생하는 지속적 색소 침착(Persistent Pigment Darkening, PPD) 을 이용하여 보통 +, ++, +++로 표시되는데 이는 각각 PPD 2-4, PPD 4-8, PPD 8+를 의미하며, 이러한 수치는 각각 어느 정도 효과가 있음, 중간 정도의 효과가 있음, 효과가 좋음을 나타내는 것으로 생각할 수 있습니다.
자외선 차단제는 제품 자체의 특성뿐 아니라 도포되는 양, 도포 방법, 재도포의 여부, 방수성 여부 등에 따라 자외선을 차단하는 정도가 달라집니다. 그러므로 자외선 차단제를 사용할 때에는 올바른 도포 방법을 알고, 이에 따라 사용해야 우리가 원하는 효과를 얻을 수 있습니다.
항상 자외선 차단지수(SPF) 15 또는 그 이상의 넓은 스펙트럼을 차단할 수 있는 자외선 차단제를 사용하는 것이 좋습니다. 따라서 자외선 차단제를 선택할 때는 SPF를 확인하도록 합니다. 자외선 차단제의 효과를 제대로 보려면 외출하기 20분 전에 피부에 발라주는 것이 좋습니다. 수영 후 땀을 많이 흘린 뒤에는 수건으로 물기를 닦은 후 자외선 차단제를 다시 발라야 합니다. 썬 램프나 썬탠실 등을 이용하지 않도록 합니다. 이런 인공적인 썬탠 방법은 피서지에 갔을 때 태양으로부터 피부를 보호하지 못합니다. 인공적인 썬탠은 피부를 손상시킬 뿐만 아니라 피부 보호에도 도움이 되지 않습니다.
항상 피부보호에 방심하지 않도록 합니다. 이전에 썬탠을 했거나 태양으로 인해 화상을 입은 적이 있는 경우, 이 지침을 따르는 순간부터 피부는 보호되기 시작합니다. 여기서 중요한 것은 자외선 차단제를 발랐다고 해서 오랜 시간 피부를 자외선에 노출시키면 안 된다는 것입니다. 자외선 차단제를 발랐을 경우 오히려 피부암의 발생이 증가했다는 보고도 있는데, 이는 자외선 차단제를 바른 후 더 오랜 시간을 야외에서 보냈기 때문인 것으로 생각되고 있습니다.

냉동 요법, 전기소작술, 소파술, 레이저 치료, 면역조절제(imiquimod)의 국소 도포, 항암제(5-FU)의 국소 도포, 광역동치료, 단순 절제술 등으로 치료가 가능합니다. 따라서 조기 진단이 가장 중요하며, 이를 위해서는 평소 피부에 관심을 갖고 주기적으로 관찰하는 것이 필요합니다.
대부분의 피부암은 조기에 진단만 하면 90% 이상이 완치될 수 있습니다. 특히 전암 병변이나 표재성 암의 경우 큰 수술 없이 냉동치료나 레이저 치료, 광역동치료, 국소 도포제 등으로도 치료가 가능합니다. 따라서 조기진단을 하는 것이 중요한데, 주기적인 자가검진이 조기진단에 큰 도움이 됩니다.
주기적인 자가검진(periodic self-examination)은 크게 전신의 피부를 빠짐없이 보는 것과 새로운 병변이 발생하거나 원래 있던 병변에서 변화가 발견될 경우 악성의 가능성이 있는지를 알아보는 것으로 나누어 볼 수 있습니다.
전신을 관찰하기 위해서는 전신용 거울과 손거울, 밝은 조명이 있는 공간이 필요합니다.

전신을 관찰할 때 중요한 점은 전신을 빠짐없이 관찰하는 것과 평소 자신의 몸에 있는 모반(점)의 위치를 기억하는 것입니다.
동양인의 경우 서양인과는 달리 손가락, 발가락 등의 사지 말단부에서 발생하는 선단흑자성 흑색종이 전체 흑색종의 약 60%를 차지합니다. 이 경우 특별한 증상 없이, 불규칙한 색조를 갖는 반점 모양을 보이는 경우가 많고, 손톱의 색만 검정색으로 변하는 경우도 있어 주의를 요합니다.
또한 피부암은 갑자기 발생할 수도 있지만 원래 존재하던 모반이나 반흔(흉터), 광선각화증 등의 피부 병변에서 이차적으로 발생하는 경우도 있어, 평소 자신의 몸에 있는 모반이나 피부 질환의 양상을 모르면 그 변화를 조기에 발견하지 못할 수도 있습니다.
양성 모반은 대부분 좌우 대칭적인 형태를 보입니다. 종양의 좌우 모양이 비대칭성을 보일 때에는 악성흑색종의 가능성을 의심해야 합니다.
양성 종양은 종양의 가장자리 모양이 굴곡이 없는 부드러운 곡선의 형태를 보입니다. 그러므로 가장자리가 울퉁불퉁하고 들쭉날쭉 할 경우에는 악성흑색종의 가능성을 의심해야 합니다.
양성 종양은 표면의 빛깔이 한 가지 색으로 균일한 색조를 보입니다. 만일 두 가지 이상의 다양한 색조 및 음영을 보인다면 악성흑색종의 가능성을 의심해야 합니다.
양성의 일반적인 검은 점은 대부분 크기가 0.6cm를 넘지 않습니다. 비교적 최근에 새로 생긴 검은 점이 0.6cm보다 클 경우에는 악성흑색종의 가능성을 의심해야 합니다.
기존의 반점의 색조가 변하거나 크기가 커지거나 두께가 두꺼워지는 등의 변화가 나타나면 악성흑색종의 가능성을 의심해야 합니다.
이 외에도(특히, 태양광선 노출 부위에) 쉽게 출혈이 일어나는 경우, 같은 자리에 병변이 지속적으로 재발하는 경우, 다치지 않았는데 가피(딱지)나 궤양이 발생한 경우, 증상이 없던 색소성 병변에서 가려움, 통증 등이 발생한 경우, 색소성 병변의 크기와 모양이 변하는 경우, 새로운 색소성 병변이 나타난 경우에도 피부암을 의심해 보아야 합니다.
편평상피세포암은 피부뿐만 아니라 점막에서도 발생하며, 발생 부위나 발생 요인에 따라 증상은 다양합니다. 일반적으로 피부가 부어올라 살덩어리가 부서진 것처럼 보이며, 비교적 붉고 크며 불균일한 모양을 보입니다. 특히 만졌을 때 응어리가 있는 경우에는 주의해야 합니다. 종양이 커지면 그 모양이 꽃양배추로 비유되기도 합니다. 그 외의 자각 증상은 특별히 없지만, 편평상피세포암에서는 종양(암)의 표면이 약해지게 되므로 일반 세균에 의한 감염이 잘 일어나며 농이 나오거나 악취가 나기도 합니다.
기저세포암의 초기 증상으로서 가장 흔히 관찰되는 것은 약간 볼록하게 나온 검은색이나 흑갈색의 병변인데, 대부분의 사람들은 이를 「점」이라고 착각합니다. 가장 대표적인 [결절-궤양형]인 경우 수년에 걸쳐 서서히 커져서 종괴를 형성하고, 더 진행되면 중심부가 함몰되어 궤양이 생기며, 그 주변부는 제방처럼 튀어나온 여러 개의 검은 구진에 둘러싸이게 됩니다. 드물게는 약간 광택이 있는 연한 붉은 색과 흰색의 반흔처럼 생긴 상태를 보이는 「반상경피증형」과 경계가 선명한 홍반으로서 표면의 피부가 딱지처럼 떨어져 나가는 상태를 보이는「표재형」 등과 같이 암이라고는 생각할 수 없는 것들도 있습니다. 일반적으로 통증이나 가려움 등의 증상은 없습니다.

가장 악성도가 높은 악성흑색종의 경우 가려움이나 통증 같은 자각 증상이 없으며 평범한 검은 반점으로 보입니다. 이에 대한 정확한 진단을 하기 위해서는 다음의 간단한 ABCDE 관찰법이 도움이 됩니다.
그러나 모든 악성흑색종이 ‘ABCDE’ 의 모양을 보이는 것은 아닙니다. 따라서 검은 점이 새로 생긴다든지, 이미 있었던 검은 점의 모양, 크기, 색조가 변하거나 그 주위가 가렵고 작열감(화끈거림) 또는 통증이 느껴진다든지, 출혈이나 궤양, 가피 형성 같은 표면 상태의 변화를 보인다든지, 또는 위성 병변(기존의 점과 인접하여 새로이 작은 점들이 생기는 경우)이 나타나면 일단 악성화를 의심하여야 합니다. 악성흑색종은 초기에는 다른 악성 종양과 마찬가지로 통증이 없습니다. 성인에서는 이미 존재하던 색소성 병변에 어떤 변화가 있을 경우에는 일단 주의를 기울이는 것이 필요합니다.
주기적인 자가검진이나 피부과적 검사에 의해 피부암으로 의심되는 병변이 발견되면 조직검사를 시행하여 확진할 수 있습니다.
정확한 진단을 위해서는 국소 마취를 하고 피부 병변의 일부를 잘라내어 현미경으로 조사하는 피부 생검을 해야 합니다. 조직 생검은 병변의 모양이나 위치, 환자의 컨디션에 따라 여러 가지 방법을 사용할 수 있습니다.

매우 두꺼운 병변도 펀치를 이용하면 쉽게 조직을 떼어낼 수 있습니다. 보통 3mm 펀치가 사용되는데, 그로 인해 생긴 상처는 모양이 둥글며 상처의 끝 부분이 거칠지 않습니다. 때에 따라서 3mm 이상이 되는 상처는 봉합을 해서 상처의 치유를 돕기도 합니다. 펀치 생검은 대부분의 깊이가 얕은 염증성이나 수포성 병변, 악성흑색종을 제외한 양성 혹은 악성 종양에 사용됩니다.
면도 생검은 융기되어 있는 병변 또는 융기된 부분의 병변을 떼어낼 때 유용합니다. 특히 모반(점)의 제거에는 탁월한 미용적 효과도 가지고 있습니다. 하지만 염증성 병변에는 사용하지 않습니다. 지루성 각화증(검버섯), 사마귀, 융기되어 있는 모반(점), 피부 표면에 있는 양성 종양이나 악성 종양 등에 사용합니다.
비교적 작은 종양에 적용하는 방법으로 국소 마취 하에서 종양 전체를 제거합니다. 제거된 조직을 가지고 조직 표본을 만들어 진단합니다. 절개된 부분은 녹거나 녹지 않는 실로 봉합해 줍니다. 결절홍반과 같이 상처가 깊은 염증성 질환이나 악성흑색종에도 사용합니다.
그 외에 종양의 침윤(주위로 퍼지는 것) 깊이나 전이 등, 병의 확산 정도를 알아보기 위해서 흉부 X선 검사와 복부 초음파검사를 비롯해, 방사성동위원소를 사용한 검사, 전산화단층촬영(CT)이나 자기공명영상(MRI) 등의 정밀검사를 필요에 따라 실시합니다. 검사를 통해 암이 어느 정도 진행되었는지를 확인하고 그에 맞추어 치료법을 선택합니다.
피부암(악성흑색종을 제외한)의 병기는 미국합동암위원회(American Jonit Committee in Cancer, AJCC)에서 정한 0기에서 4기까지 5단계로 분류할 수 있는데 다음과 같습니다.




다음은 AJCC에서 종양의 두께와 조직 침범 정도를 기준으로 악성흑색종의 진행 단계를 4단계로 분류한 것입니다.

[참고]
피부암은 다양한 방법으로 치료가 가능합니다. 치료의 선택은 병변의 위치와 크기, 병변의 수, 병리학적 검사 상 종양의 특징, 환자의 건강 상태, 예전에 치료 받은 과거력 등 여러 가지 요인들을 고려하여 결정하게 됩니다.

병변과 주위의 정상 경계부를 일부 포함하여 종양을 제거하는 방법으로 가장 흔히 사용되는 치료 방법입니다. 수술에 의한 피부 결손이 심한 경우에는 피부 이식을 함으로써 부족한 피부를 채웁니다.
모즈현미경도식 수술은 제거한 조직에서 종양 세포의 존재를 확인해 가면서 종양을 완전히 제거하는 방법입니다. 발견된 종양 세포를 그림이나 폴라로이드 사진으로 제작한 도식과 비교하여 위치를 확인하고 그 부위를 다시 절제해 나갑니다. 이러한 방법으로 종양의 절제 절편 경계부 전부에서 암세포가 없는 것이 확인되면 결손부를 복원합니다. 모즈현미경도식 수술의 장점은 특히 종양 수술 부위가 얼굴인 경우의 두 가지 목적인 병변의 완전 제거와 최대한의 조직 보존을 모두 만족시킨다는 것입니다. 그러나 모즈현미경도식 수술은 냉동 조직절편 처리 및 현미경 판독, 재건 수술 기법 등에 대한 숙련된 기술을 겸비한 의사와 기사가 있어야 하고 수술 과정이 길다는 단점이 있습니다.
모든 피부암에서 모즈 수술이 필요한 것은 아니며, 재발의 위험이 큰 피부암, 전이의 위험이 큰 피부암, 중요한 부위에 발생하여 피부의 보존이 필요한 피부암 등에서 사용될 수 있습니다. 구체적으로 살펴보면, 재발한 피부암, 크기가 큰 피부암의 경우, 면역이 억제되어 있는 경우, 임상적으로 경계가 불분명한 경우, 입술, 귀, 코끝, 손끝, 눈꺼풀, 성기 부위 등에 발생한 경우, 조직학적으로 악성도가 높아 재발의 위험이 높은 경우 등을 들 수가 있습니다.

소파 및 전기소작술은 국소마취 하에서 피부를 소독한 후 실시합니다. 먼저 보이는 종양을 큐렛(소파기)으로 종양의 둘레보다 2~4 mm정도 바깥쪽까지 긁어냅니다. 다음에 전기 소작기로 정상 조직을 1 mm정도 더 제거합니다. 이 방법은 1 cm 미만의 종양에서는 효과가 좋고 흉터가 다른 치료법보다 더 적게 남는다는 장점이 있지만 5년 내 재발률이 목이나 몸체에서 8.6%, 사지에서와 얼굴에서 17.5%로 높은 수치를 보인다는 단점이 있습니다. 그러므로 1 cm 미만의 표재성 또는 결절성 기저세포암이나 광선각화증 등에 쓰입니다. 이 같은 전기소작술은 고주파 전류를 이용하므로 심박 보조 조정기(cardiac pacemaker)에 장애를 초래할 수 있습니다. 최근에 사용되는 심박동조율기는 절연이 잘되어 있어 큰 문제는 없으나 위험을 예방하기 위해 반드시 의사와 상의해야 합니다.
액화질소를 사용해서 암조직 내의 온도가 -20℃에서 -50℃가 되도록 냉각하여 암세포를 동결 괴사시키는 방법입니다. 종양의 하부로 침범된 깊이가 얕은 암은 이 방법으로 치료할 수 있습니다. 냉동수술은 치료 도중이나 치료 후에 신체에 대한 영향이 적기 때문에 고령의 환자나 지병 때문에 건강 상태가 좋지 않은 분에게도 적합한 치료법입니다.
냉동수술은 피부조직을 파괴하는 정도의 영하의 온도에 병변을 노출하는 것입니다. 성공적인 냉동수술를 위해서는 종양 내부조직의 온도가 영하 50℃에서 영하 60℃까지 도달해야 합니다. 냉동수술이 끝난 직후에는 보통 치료 부위에 국소적 홍반이나 부종이 나타납니다. 삼출성의 병변이 1~3일 정도 지속되고 그 후에 딱지가 형성되는데 이러한 과정은 약 일주일 정도 걸립니다. 얼굴에 냉동수술을 적용하면 약 4~6주 정도 걸리며, 그 외 몸통이나 팔다리에 냉동수술을 적용했을 때는 약 12~14주 정도 걸립니다.
병변 부위에 광과민성물질(5-aminolevulinic acid, ALA)을 도포한 다음, 목표 조직에 축적되도록 충분한 시간이 지난 후, 가시광선을 조사하여 반응성 산소종을 활성화시킴으로써 목표조직을 선택적으로 파괴하는 일종의 광화학요법입니다. ALA는 정상 피부보다 암세포에서 더 선택적으로 축적되며 빛과 더 예민하게 반응하여, 주변 정상 조직의 손상 없이 암세포만을 선택적으로 파괴할 수 있습니다. 피부과 영역에서는 다양한 피부 질환에 사용하고 있는데, 광선각화증, 보웬병, 표재성 기저세포암, 편평상피세포암의 조기 병변 등(병변의 깊이가 2-3 mm를 넘는 경우 사용할 수 없음.)에서 사용하고 있습니다. 광역동치료는 비침습적인 치료로 반복 치료가 가능하며, 부작용이 적고, 반흔이 거의 없어 기존의 방법으로는 치료가 어려운 경우 유용한 치료법이 될 수 있습니다.
방사선 치료는 수술하기에는 적합하지 않은 광범위한 병변이나, 수술을 원치 않는 환자의 경우, 그리고 여러 가지 동반 질환을 가지고 있어 수술하기에 위험한 경우에 선택할 수 있는 첫 번째 치료로 외과적 수술의 보조 요법으로도 사용될 수 있습니다. 방사선 치료의 장점은 치료 부위가 코, 안검, 구순일 때는 조직을 보호할 수 있다는 것입니다. 그러나 이 치료는 젊은 환자에게는 최우선 치료로 사용되지 않습니다. 방사선 치료 부위에 다른 암이 발생할 위험이 있고, 미용적으로도 좋지 않은 결과를 가져올 수 있기 때문입니다.
기저세포암의 경우 방사선 치료 후 90% 이상의 완치율을 보이는 반면, 편평상피세포암은 이보다 재발률이 조금 높습니다. 따라서 비흑색종성피부암의 방사선 치료는 모즈 수술의 경우 완치율이 97-99%라는 점을 염두에 두고 여러 가지 사항을 고려하여 선택되어야 합니다. 악성흑색종의 경우, 방사선 치료에는 잘 반응하지 않지만, 뇌나 뼈에 전이되어 동통이 심한 경우에는 효과적으로 사용될 수 있습니다.
방사선 치료에는 몇 가지 방법이 있는데, 전용 기계를 사용하여 X선이나 전자선을 신체 바깥에서 쏘이는 방법이 일반적입니다. 보통 1회의 조사가 단시간 내에 끝나기 때문에 통원 치료가 가능합니다. 또한 암이 생긴 부위에 따라 암세포가 정상 세포에 비해 열에 약한 경우가 있는데, 이러한 경우 온열요법을 병용하여 치료 효과를 더욱 높이기도 합니다.
방사선 치료 시에는 다음과 같은 사항을 주의하도록 합니다. 먼저, 방사선 치료를 받은 부위가 직사광선에 노출되는 것을 피해야 하며, 방사선 조사 후 2~3시간은 조사 부위에 로션이나 크림을 바르지 않아야 합니다. 또한 방사선을 쏘인 부위는 약한 비누와 샴푸(베이비 샴푸)를 이용해 미지근한 물로 씻어줍니다. 물기를 닦을 때는 가볍게 두드려서 말리도록 하며 향수나 탈취제는 사용하지 않도록 합니다. 그리고 조사 부위에 전기 패드나 뜨거운 물병, 얼음주머니를 대지 않도록 하며, 면도기를 사용해야 할 때는 전기면도기를 사용하도록 합니다.
두 가지의 국소 도포 제제(5-FU 크림, 알다라 크림)가 주로 사용됩니다.
항암제인 5-FU(fluorouracil) 크림은 광선각화증이나 표재성 기저세포암에 사용되어 좋은 치료 효과를 나타내며, 병변이 광범위하게 퍼져 있을 때 주로 사용됩니다. 하지만 보웬병이나 결절성 기저세포암과 같이 병변이 깊은 경우 재발율이 높습니다.
면역조절제인 알다라 크림(imiquimod)은 밀폐 없이 사용할 경우 보통 일주일에 5회, 밀폐할 경우 일주일에 3회 정도를 바릅니다. 이 역시 광선각화증이나 표재성 기저세포암에 주로 사용이 가능하며, 보웬병에서도 좋은 효과를 보입니다.
이러한 약제를 사용할 때는 반드시 바르기 전과 후에 약한 비누를 이용해 손을 깨끗이 씻도록 합니다. 또한 약제를 사용하기 전 반드시 의사와 상의하도록 합니다.
수술이나 방사선 치료는 국소요법이라고 하여, 신체의 일부분을 치료하는 방법입니다. 그러나 어느 정도 암이 진행된 경우에는 전신요법인 항암 화학요법이 치료의 중심이 됩니다.
특히, 이른 시기에 전이가 일어나는 악성흑색종의 경우에는 원발 병변의 수술적 제거 후 항암 화학요법이 병행되는 경우가 많습니다. 악성흑색종에 효과가 있는 항암제는 다카르바진(DTIC), 카르무스틴(BCUN), 로무스틴(CCNU), 시스플라틴 등이 있으며, 이들을 단일요법으로 혹은 복합적으로 사용하기도 합니다. 그리고 악성흑색종에 효과가 있는 이들 약제와 항암 효과가 미약한 다른 약제를 복합적으로 사용하기도 합니다.
면역체계가 흑색종의 발병 기전에 관련이 있다는 사실이 알려져 있어 여러 종류의 생물학적 물질이 전이성 흑색종 치료에 시도되고 있습니다. 이 중 가장 많이 시도되고 있는 것은 인터페론-알파(α)와 인터루킨(IL)-2인데 재조합 인간 인터페론-알파는 흑색종에 대한 항암 효과가 있는 것으로 밝혀져 있습니다. 그 외 각종 단클론항체와 능동 면역요법 등이 연구 중에 있습니다.
어느 정도 진행된 피부암에 대해서는 먼저 열거한 치료법 중에서 하나만을 골라 치료하지 않으며, 이들 모두를 잘 조합해서 가장 효과를 볼 수 있는 치료를 실시합니다. 이것을 복합적 치료라고 합니다.
외과적 수술법, 특히 모즈현미경도식 수술요법은 시술함에 있어 다른 시술보다 더 많은 전문 인력과 장비가 필요하며 시술 시간도 오래 걸립니다. 수술 후 상처가 감염되거나 통증, 부종, 혈종 등이 올 수 있고, 경우에 따라서 복원을 위한 성형수술이 필요할 수 있습니다.
냉동수술 후에는 부종과 수포가 발생할 수 있고, 진물이 흐르며 가피가 형성될 수 있습니다. 두피, 손, 발에 위치한 병변의 치료 후 동통이 발생하기 쉬우나 진통제가 필요한 경우는 드뭅니다. 흔하지는 않지만 항응고제를 복용 중인 환자에게서 출혈의 가능성이 있습니다. 또한 윗입술이나 가슴의 병변을 치료했을 때는 비후성 반흔이 남기도 하며, 하지와 배부위 등에서는 시술 후 과색소침착이 나타날 수 있습니다.
광선 조사 시 통증, 작열감, 소양증 등을 느낄 수 있으며, 조사 후 홍반, 부종, 수포, 미란, 궤양 등이 발생할 수 있습니다. 이들은 대개의 경우 특별한 치료 없이 자연 치유됩니다. 그 외에 저색소침착, 과색소침착, 반흔 등이 발생할 수 있습니다.
외부 방사선 치료는 일반적으로 국소적 치료로 사용되며, 피부를 포함해서 방사선이 통과한 조직에 영향을 미칩니다. 피부의 변화는 방사선을 쏘이는 동안이나 쏘인 직후, 또는 쏘인 후 수개월이나 수년 후에 발생하게 됩니다. 조사된 피부에서의 조기 부작용으로는 탈모, 홍반, 색소침착, 건조성 및 습윤성 피부 박리가 있으며 이러한 조기 반응은 염증성 부위와 겨드랑이처럼 피부에 주름이 잡히는 부위에서 더 많이 나타납니다. 이러한 반응은 일반적으로 치료가 끝난 뒤 4~6주 후에 치유됩니다. 모발 손실은 보통 치료 후 4주 정도에 시작되며 조사 부위에 국소적으로 일어납니다. 모발 손실은 고용량으로 조사한 경우를 제외하고는 보통 일시적인 것으로 2~3개월 후 다시 머리카락이 자라기 시작합니다. 새로운 모발은 질감과 색깔이 치료 전과 약간 다를 수 있습니다. 방사선 치료의 후기 효과로 모세혈관확장증, 피부위축, 과색소 혹은 저색소 침착 등이 생길 수 있습니다. 조사 부위의 표피층은 흔히 색소의 침착과 더불어 건조하고 얇아지며, 특히 고용량의 조사 부위에서는 섬유화가 나타나기도 합니다.
항암제인 5-FU 크림을 바르는 경우 작열감, 소양감, 동통, 홍반, 부종 등의 피부 자극 증상이 나타날 수 있으며, 그 외에 과색소나 저색소 침착, 알레르기접촉피부염, 광과민성 반응 등이 나타날 수 있습니다. 알다라 크림의 경우 크림을 바른 국소 부위에 작열감, 가려움, 홍반, 미란 등의 피부 자극이 부작용으로 나타날 수 있습니다. 국소 도포 치료의 경우 전암 병변이나 표재성 기저세포암 같이 병변의 깊이가 얕은 병변에 주로 사용하여야 하며, 깊은 병변에 사용할 경우 재발률이 높습니다.
전신 항암 화학요법에서 발생할 수 있는 부작용은 구역질과 구토, 구내염, 설사, 골수 기능 장애 등이 나타날 수 있습니다.
전이는 기저세포암은 매우 드물어 0.0028~0.55%로 보고되고 있고, 편평상피세포암은 이보다는 높아 0.5~0.6%정도로 보고되고 있습니다.
기저세포암의 경우 치료방법에 따라 다양하게 재발률이 나타나는데 소파 및 전기소작술이나 냉동수술, 5-FU이 도포의 경우 재발률이 비교적 높은 반면 (소파 및 전기소작술, 모즈수술의 경우 약1% 정도로 낮습니다. 하지만 한번 기저세포암이 발생하면 다시 발생할 확률이 36~50%정도로 보고되고 있어 정기적인 추적관찰이 필요합니다. 편평상피세포암의 경우도 크기가 2cm이상 크거나, 얼굴이나 두피에 발생하였거나 면역력이 저하된 경우 등에서 재발률이 더 높게 나타나며, 편평상피세포암도 귀나 입술에 발생하거나 크기가 2cm이상, 침윤 깊이가 4mm이상 등에서 재발률이 높게 나타납니다. 따라서 위험도에 따라 3~12개월 간격으로 주기적인 관찰이 필요합니다. 그러므로 피부과 전문의와 상의하여 주기적으로 자가검진 및 진료를 받는 것이 중요합니다.
암이나 암치료와 관련되어 국소적 또는 전신적으로 올 수 있습니다. 국소적 가려움은 피부의 암 전이나 방사선치료 같은 국소적 치료와 관련되어 나타나며, 전신적 가려움은 항암화학요법이나 생물요법 등 전신적 치료와 관련되어 나타납니다.
정확한 원인은 아직 알려져 있지 않지만, 질병과 관련되어 나타나는 전신성 소양증은 혈중으로 순환하는 독성 물질 때문입니다. 가려움이 있을 때는 손톱을 짧게 깎고 면장갑을 착용하여야 하며, 부드러운 면 의류와 침대 시트를 사용하고 헐거운 옷을 입도록 합니다. 또한 피부를 긁지 않는 것이 가장 좋으나 피부가 간지러울 땐 손바닥이나 부드러운 천으로 가려운 부위 주위를 부드럽게 꼭꼭 누르거나, 부드럽게 문질러 주거나, 피부를 조심스럽게 두드려 줍니다. 주사를 맞아야 한다면 주사 부위를 돌아가며 바꾸도록 합니다.
가려움을 느낄 때는 피부가 건조해지지 않도록 하며 가습기를 틀어 놓도록 합니다. 또한 실내온도를 차게 유지하되 땀이 나는 활동은 삼가도록 하며 약한 비누나 교질 오트밀을 이용해 10~20분간 미지근한 물로 목욕을 하도록 합니다. 필요에 따라 윤활제나 목욕오일, 로션 혹은 크림이나 연고를 사용하며 미지근한 물 또는 냉습포 찜질을 해도 좋으나 향수나 탈취제는 사용하지 않도록 합니다.
피부가 심하게 건조해졌을 때는 다음과 같은 사항들을 기억하여 따르도록 합니다.피부가 건조해졌을 때는 피부를 긁지 않도록 하며 건조한 피부에는 테이프를 붙이지 않으며, 적절한 철분, 아연, 단백질이 포함된 음식을 골고루 섭취하도록 합니다.또한 자극이 약한 비누나 샴푸, 필요시 약물을 이용해 미지근한 물로 1~2일 마다 목욕을 하되 잦은 목욕은 피하도록 합니다. 목욕이 끝난 후에는 적절한 보습제를 이용해서 피부의 수분을 지켜주며 필요하면 도포용 피부연화제를 바르도록 합니다.습진성 변화가 있을 때는 국소 스테로이드제를 바르는데 흡수를 촉진시키기 위해서는 젖은 피부에 연고를 바르는 것도 좋습니다.피부가 건조해졌을 때는 열 패드나 뜨거운 물병, 얼음주머니를 사용하지 않도록 하며, 헐겁고 부드러운 면직물을 입도록 합니다. 실내는 시원하게 유지하며 습도는 30~40% 정도가 적당합니다.